UM POUCO DE HISTÓRIA...
Os atomistas, da Grécia
antiga, pensavam que a matéria era
constituída por partículas minúsculas e invisíveis, os átomos. Este nome (átomo)
foi dado pelo filósofo grego Demócrito (546 – 460 a.C.), significa
“sem divisão” ou “indivisível” (a = não; tomos = divisões).

MODELO DE DALTON
John Dalton, em 1803, tenta explicar o comportamento dos
gases da atmosfera e das misturas gasosas. Assim como os gregos, Dalton
acreditava que a matéria era constituída por átomos indivisíveis e espaços
vazios. Imaginava o átomo como uma pequena esfera, com massa
definida e que continha propriedades características.
MODELO DE THOMSON
O britânico Joseph John Thomson descobriu os elétrons em
1897, propôs que o átomo era divisível em partículas carregadas positiva e
negativamente, contrariando o modelo proposto por Dalton. Consistia em uma
grande partícula positiva com elétrons (cargas negativas)
incrustadas nela, como passas em um pudim.
MODELO DE RUTHERFORD
Em 1911, Ernest Rutherford chegou a conclusão que:
·
No átomo existem espaços vazios;
·
No centro do átomo existe um núcleo muito pequeno e
denso;
·
O núcleo tem carga elétrica positiva.
Portanto, pelo modelo atômico de Rutherford, o átomo é
constituído por um núcleo central, dotado de cargas positivas (prótons), envolvido
por uma nuvem de cargas negativas (elétrons).
MODELO DE BOHR
O modelo de Niels Bohr, de 1913, foi um grande avanço para a
comunidade científica, provando que o átomo não era maciço. O elétron orbitaria
o núcleo em órbitas estacionárias, sem perder energia. A teoria quântica permitiu-lhe
formular essa concepção de modo mais preciso: as órbitas não se localizariam a
quaisquer distâncias do núcleo, pelo contrário, apenas algumas órbitas seriam
possíveis, cada uma delas correspondendo a um nível bem definido de energia do
elétron. A transição de uma órbita para a outra seria feita por saltos, pois, ao absorver energia, o elétron saltaria
para uma órbita mais externa (conceito
quantum) e, ao emiti-la,
passaria para outra mais interna
(conceito fóton).
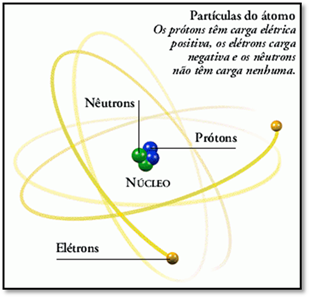
COMO FUNCIONA O MODELO DE BOHR?
Conforme vimos acima, para chegarmos à definição de átomo que
conhecemos hoje, passamos por vários estudos. E atualmente entende-se que o átomo é
a menor partícula que ainda caracteriza um elemento químico. O átomo é composto de
partículas menores: os prótons, os nêutrons e os elétrons. Sendo o átomo
constituído de um núcleo (bastante pequeno), com cargas elétricas positivas
(prótons) e neutras (nêutrons), é nele que está a maior parte da massa do átomo. E
ao redor desse núcleo está uma configuração de partículas com carga elétrica
negativa (elétrons), que determinam o seu tamanho.
Por ser muito pequena, a medida do átomo é representada em notação científica. Porém, a notação científica também é utilizada para representar números muito grandes, como mostra o vídeo abaixo.